心脏结构异常与运动员SCD
HCM的发生率为0.2%,运动员中为0.07%~0.08%。HCM为常染色体显性遗传性心脏病,临床表现以左心室肥厚为特征。运动增加HCM患者发生SCD风险,HCM是美国年轻运动员赛场猝死最常见原因。HCM所致的SCD常发生于橄榄球、篮球运动,很少发生于划船、长距自行车、跑步等耐力性运动。原因可能与HCM患者更倾向选择非耐力性运动有关(HCM患者往往合并心脏舒张功能受损、心肌缺血、左心室流出道梗阻,限制了长时间心搏量输出)。HCM诊断主要依赖于心电图(ECG)和超声心动图(UCG)检查。90% HCM患者的静息ECG存在异常(图2A、2C)。有心脏停搏及持续性室性心动过速(VT)的高危SCD的HCM患者都需置入ICD。
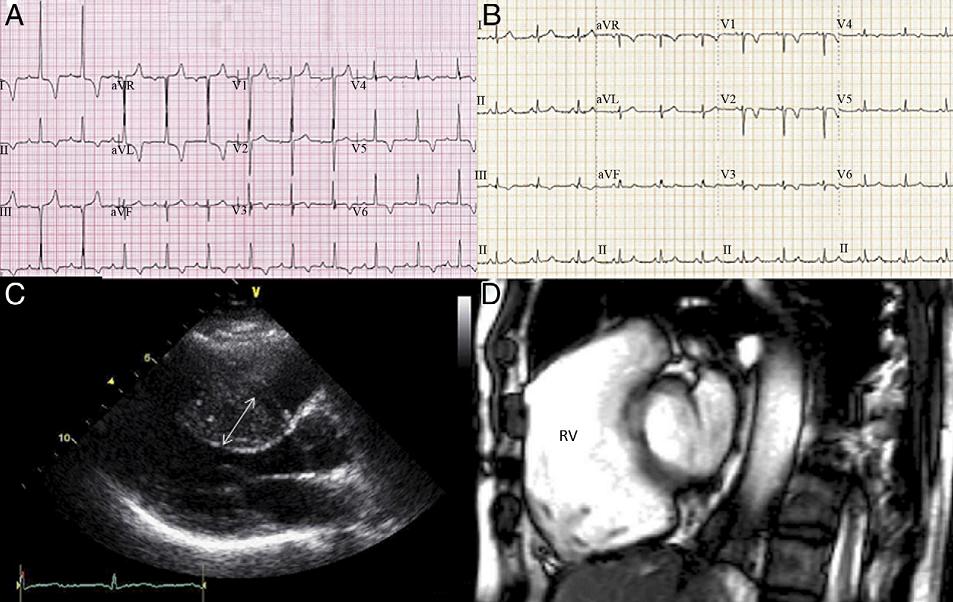
图2. HCM和ARVC患者ECG及影像学异常表现(A:HCM患者ECG提示心电轴左偏,增高的电压符合左心房扩大和左心室肥厚诊断标准;B:ARVC患者ECG提示右胸导联T波倒置;C:经胸心脏超声提示HCM患者室间隔显著非对称增厚,箭头所示厚度为22 mm;D:心脏MRI提示ARVC患者右心室扩张,室壁纤维化。)
ARVC ARVC为一种常染色体显性遗传性疾病,一般人群发病率1/1000。竞技性运动导致ARVC患者SCD发生率增加5倍,意大利一项研究报道25%的运动员猝死为ARVC所致。ARVC导致猝死机制较复杂,可能与运动致右心室急性扩张,心肌细胞延伸,细胞分离,从而导致室性心律失常及猝死。对SCD幸存者研究发现,局部心肌炎症及随后愈合导致心肌细胞被脂肪组织进展性替代,形成VT/心室颤动(VF)的基质。ARVC诊断依赖于2010年制订的标准,包括症状、家族史、静息/运动ECG变化,UCG和心脏MRI及心肌组织定性检查(图2B、2C)。
先天性冠状动脉畸形(CCAA) CCAA造成了12%~33%的运动员猝死。最常见冠状动脉畸形为左冠状动脉起源于右冠窦,或右冠状动脉起源于左冠窦。运动导致SCD机制可能为起源走行异常的冠状动脉受压或痉挛影响血液供应,造成心肌内皮功能紊乱,心肌缺血,诱发室性心律失常。CCAA导致的SCD幸存者先前常无症状。诊断:ECG、UCG和运动试验检查很难发现CCAA。心脏MRA和冠状动脉CTA是诊断CCAA金标准。治疗上首先推荐外科矫正。对于无症状运动员,哪些类型的AACC需外科治疗还存争议。
其它心脏结构异常 其它与SCD有关的心脏结构异常主要包括主动脉夹层(大多由Marfan综合征引起)、二尖瓣脱垂及主动脉瓣狭窄。①Marfan综合征为一种常染色体显性遗传性疾病。发生率1/5000。3%的年轻运动员运动相关SCD与之相关。其机制为运动造成主动脉压力升高,使已存在中膜囊性坏死的主动脉破裂,导致猝死。②二尖瓣脱垂普通人群发病率3%~5%,二尖瓣脱垂发生SCD的报道较少,目前报道只有不到100例患者单纯存在二尖瓣脱垂,其中仅3例猝死与运动有关。猝死与室性心律失常有关,确切机制不详。③主动脉瓣狭窄中主动脉瓣二叶畸形有关的主动脉瓣狭窄较少见,但目前认为该结构异常可造成年轻运动员猝死。
上一页 [1] [2] [3] [4] [5] [6] 下一页